
科目: 来源: 题型:选择题
| A. | 0.02mol/L | B. | 0.5mol/L | C. | 5mol/L | D. | 5.6 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①②④③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl、I2 | B. | NaCl、NaBr、NaI | C. | NaBr、NaI | D. | NaCl、NaI、I2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移电子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放热反应放出热量的多少与反应物的质量和状态有关 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 吸热反应的发生都需要加热,吸热反应都没有利用价值 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ④>③>②>① | C. | ④>③>①>② | D. | ①>④>③>② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走滴管中的空气 | |
| B. | 向烧杯内滴加试剂时,将滴管悬空放在烧杯上方,将试剂滴下 | |
| C. | 取液后的滴管保持橡胶乳头在上,不可倒置或平放 | |
| D. | 除滴瓶上的滴管外,用过的滴管应立即用清水冲洗干净 |
查看答案和解析>>
科目: 来源: 题型:填空题
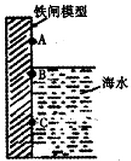 铁闸中的A、B、C三点中,C点的电极反应方程式为Fe-2e-=Fe2+将此铁闸与电源的负极相连可起到保护该铁闸的作用.对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中的一个反应的方程式为:请配平该反应方程式.
铁闸中的A、B、C三点中,C点的电极反应方程式为Fe-2e-=Fe2+将此铁闸与电源的负极相连可起到保护该铁闸的作用.对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中的一个反应的方程式为:请配平该反应方程式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com