
科目: 来源: 题型:选择题
| A. | 茶 | B. | 西瓜 | C. | 大豆 | D. | 甜菜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | H2很难与砹化合 | D. | HAt比HCl稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3 NaHCO3 CH3COONa NaF | |
| B. | NaHCO3 Na2CO3 CH3COONa NaF | |
| C. | NaF CH3COONa Na2CO3 NaHCO3 | |
| D. | NaF CH3COONa NaHCO3Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C1>C2 | |
| B. | 两瓶溶液的导电能力相同 | |
| C. | 第一瓶溶液的pH大于第二瓶溶液的pH | |
| D. | 第一瓶溶液中醋酸的电离程度小于第二瓶溶液中醋酸的电离程度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2=CH-COOH | B. | CH2=CH-CH2OH | C. | CH2=CH-CHO | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 乙烯使溴水褪色的反应 | |
| B. | 乙炔使酸性高锰酸钾溶液褪色的反应 | |
| C. | 甲烷与氯气在光照下的反应 | |
| D. | 乙烯在催化剂作用下与水反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的量浓度相同的NaCl溶液和NaClO溶液,NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 | |
| B. | 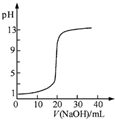 如图表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 中和同体积、同浓度的盐酸时,消耗pH相同的氨水、氢氧化钠和氢氧化钡溶液的体积大小关系是:氨水<氢氧化钡<氢氧化钠 | |
| D. | 在NaH2PO4水溶液中存在关系:C(H3PO4)+C(H+)═C(HPO42-)+C(PO43-)+C(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | W | |||
| Y | Z |
| A. | X元素形成的氢化物液态比固态的密度小 | |
| B. | 四种元素行成的简单离子半径从大小的排列顺序Y>Z>X>W | |
| C. | 常温下,Y形成的简单离子和W形成的简单离子在水溶液中可以大量共存 | |
| D. | Y常用于冶炼难熔的金属 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 溶质 | NaHSO3 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 5.8 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| 序号 | Ba(OH)2溶液体积/mL | 盐酸体积/mL | 混合液pH |
| 1 | 22.00 | 0 | 10 |
| 2 | 22.00 | 18.00 | 9 |
| 3 | 22.00 | 22.00 | 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com