
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2=CH2+HCl $→_{△}^{催化剂}$ CH3CH2Cl | |
| B. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| C. | nCH2=CH2$→_{加热、加压}^{催化剂}$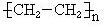 | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯的最简式:C6H6 | B. | 乙烯分子的结构简式为:CH2CH2 | ||
| C. | 一氯甲烷的电子式为: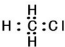 | D. | 2-甲基丁烷的键线式: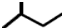 |
查看答案和解析>>
科目: 来源: 题型:解答题
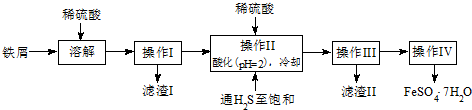
查看答案和解析>>
科目: 来源: 题型:解答题

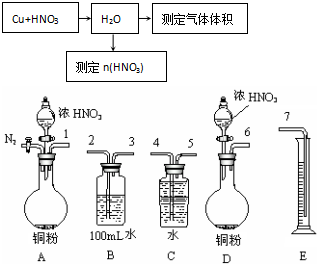
查看答案和解析>>
科目: 来源: 题型:推断题
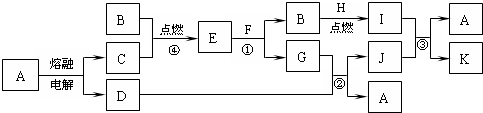
 ;
;查看答案和解析>>
科目: 来源: 题型:推断题
 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6:3:2 | B. | 1:2:3 | C. | 3:6:2 | D. | 2:1:3 |
查看答案和解析>>
科目: 来源: 题型:选择题
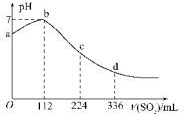 标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )| A. | 亚硫酸是比氢硫酸更弱的酸 | |
| B. | ab段反应是:SO2+2H2S═3S↓+2H2O | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol/L | |
| D. | b点对应的溶液导电性最强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 每生成1mol Fe3O4,反应转移的电子总数为3mol | |
| B. | Fe2+和S2O32-都是还原剂 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | x=6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com