
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Li、Na、K元素原子的核外电子层数随着核电荷数的增加而增多 | |
| B. | 第二周期元素从Li到F,非金属性逐渐增强 | |
| C. | 因为Na比K容易失电子,所以Na比K的还原性强 | |
| D. | F与Cl为同主族的元素,且F比Cl的非金属性强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | R一定是第2周期元素 | |
| B. | R一定是VA族元素 | |
| C. | R的气态氢化物一定比同周期其他元素气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,C和E形成化合物的电子式
,C和E形成化合物的电子式 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 硼的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt见光容易分解,但不溶于水也不溶于稀酸 | |
| C. | 氢氧化铷(RbOH)易溶于水 | |
| D. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通H2的极是正极,通入O2的极是负极 | |
| B. | 通O2的极是正极,通入H2的极是负极 | |
| C. | 工作一段时间后电解质溶液碱性增强 | |
| D. | 工作时负极区附近碱性不变 |
查看答案和解析>>
科目: 来源: 题型:实验题
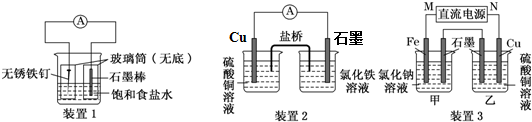
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com