
科目: 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都是物理变化 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 分子组成上相差一个或若干个“CH3”原子团的两种有机物必定互为同系物 | |
| D. | 相对分子质量相等的两种有机物必定是同分异构体 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
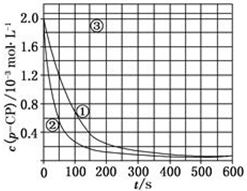 [数据处理]实验测得p-CP的浓度随时间变化的关系如图:
[数据处理]实验测得p-CP的浓度随时间变化的关系如图:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
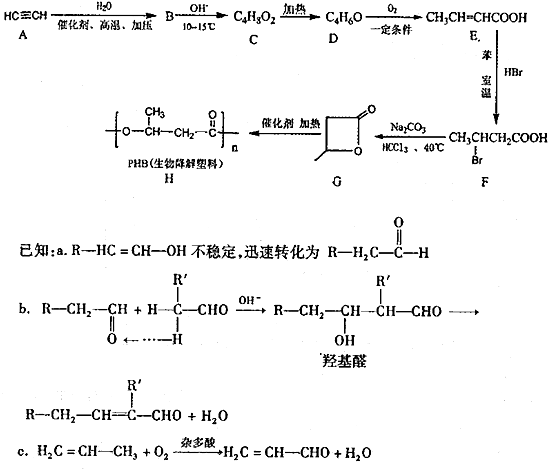
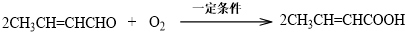 .
.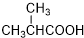 .
.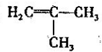 为起始原料(其他原料任选),制备
为起始原料(其他原料任选),制备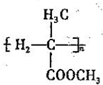 的合成路线:
的合成路线: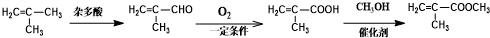
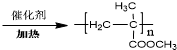 .
.查看答案和解析>>
科目: 来源: 题型:实验题
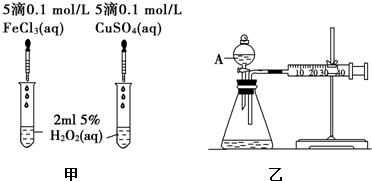
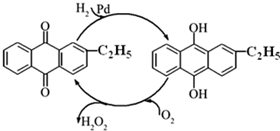 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.| 实验编号 | T/X | H2O2初始浓度/moL•L-1 | FeCl3初始浓度/moL•L-1 |
| I | 20 | 1.0 | 0 |
| n | 50 | 1.0 | 0 |
| in | 50 | 1.0 | 0.1 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 品名:XX火腿肠 净含量:150g 生产日期:见封口 保质期:25℃以下6个月 配料:精选瘦肉、大豆蛋白、鸡蛋、淀粉、白砂糖、食盐、 食用香精、山梨酸钾、亚硝酸钠、维生素C 储存指南:避免日晒,置阴凉干燥处 生产厂家:XX食品有限公司 地址:XX市XX路XX号 |
查看答案和解析>>
科目: 来源: 题型:选择题
| No | 项目 | 结果 | 正常范围参考值 | 单位 |
| 1 | 红细胞计数 | 2.3 | 3.5~5 | 1×10 12/L |
| 2 | 血红蛋白 | 75 | 110~150 | g/L |
| 3 | 血小板计数 | 205.5 | 100~300 | 109/L |
| A. | 钙 | B. | 铁 | C. | 锌 | D. | 钠 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 煤可以直接液化,使煤与氢气作用生成液体燃料 | |
| B. | 利用风能、生物能发电,将火力发电用煤进行脱硫处理,有利于环保 | |
| C. | 氮化硅陶瓷、通讯光缆等都是新型无机非金属材料 | |
| D. | 塑料、橡胶、纤维这三大材料都是以石油、煤、天然气为原料生产的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com