
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有NA个氢原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| D. | 标准状况下,11.2LH2O含有的分子数为0.5NA |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
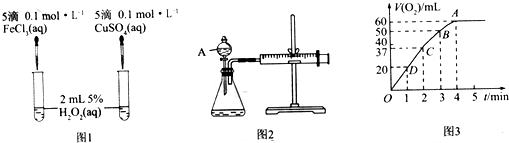
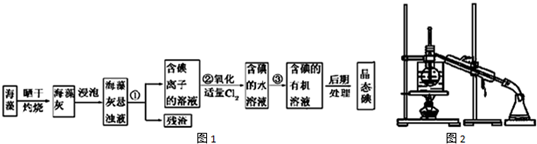
查看答案和解析>>
科目: 来源: 题型:解答题
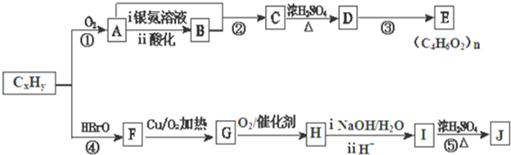
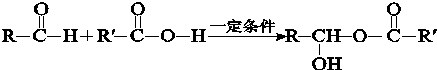

查看答案和解析>>
科目: 来源: 题型:解答题
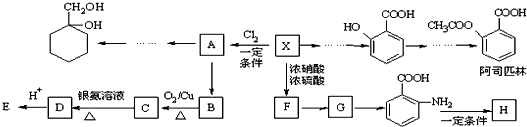
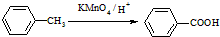
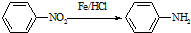 (苯胺,易被氧化)
(苯胺,易被氧化) ,F→G的反应类型是氧化反应.
,F→G的反应类型是氧化反应. .
.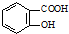 的同分异构体的结构简式
的同分异构体的结构简式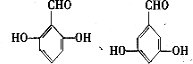 .(写出2种)
.(写出2种)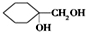 ,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:
,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:查看答案和解析>>
科目: 来源: 题型:推断题
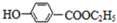 ,下列反应①-⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明.
,下列反应①-⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明.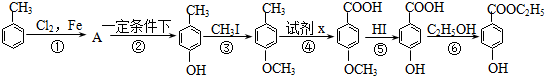 ).
).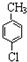 .A的名称为对氯甲苯.
.A的名称为对氯甲苯.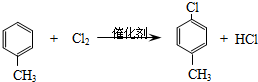 .
.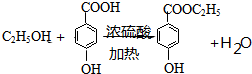 .
. 的同分异构体中,既能与NaHCO3发生反应,又能与FeCl3溶液发生显色反应的共有13种,其中核磁共振氢谱为5组峰,且峰面积比为2:2:2:1:1的为
的同分异构体中,既能与NaHCO3发生反应,又能与FeCl3溶液发生显色反应的共有13种,其中核磁共振氢谱为5组峰,且峰面积比为2:2:2:1:1的为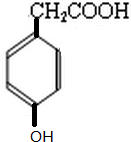 (写结构简式).
(写结构简式).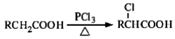 ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备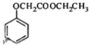 的合成路线流程图(无机试剂任用).合成路线流程图例如下:
的合成路线流程图(无机试剂任用).合成路线流程图例如下:查看答案和解析>>
科目: 来源: 题型:推断题
 ,取代反应;
,取代反应; ,取代反应或水解反应;
,取代反应或水解反应; +3H2O,酯化反应.
+3H2O,酯化反应. ,消去反应.
,消去反应.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2+O2═2H2O△H=-571.6KJ/mol | |
| B. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-142.9KJ/mol | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8KJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com