
科目: 来源: 题型:解答题
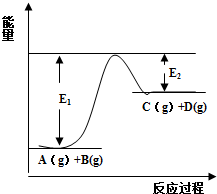 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(HCO3-)>c(ClO-)>c(OH-) | B. | c(ClO-)>c(HCO3-)>c(H+) | ||
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
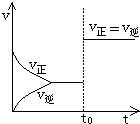 可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )
可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )| A. | 只能通过加入催化剂实现 | B. | 可能通过增大压强来实现 | ||
| C. | 可能通过升高温度实现 | D. | a+b一定不等于c |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 | |
| B. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| C. | 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 上述反应中生成的N2是火箭燃料燃烧后的氧化产物 | |
| B. | 推动火箭飞行的强大动力源于该反应瞬间产生的大量高温气体 | |
| C. | 火箭发射时看到的红棕色气体是火箭起飞后,保险活动门自动开启,排出部分高压氧化剂在空气中氧化的结果 | |
| D. | 从能量变化上看,上述反应是热能转化为动能 |
查看答案和解析>>
科目: 来源: 题型:实验题
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
查看答案和解析>>
科目: 来源: 题型:解答题
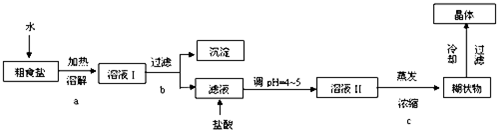
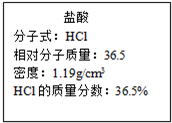
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com