
科目: 来源: 题型:推断题
 【有机化学基础】
【有机化学基础】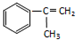 出发来合成M,路线如下:
出发来合成M,路线如下: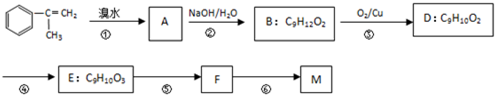
 .
. .
.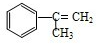 +Br2→
+Br2→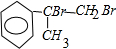 ;
;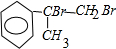 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$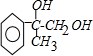 +2NaBr;
+2NaBr; +CH3OH $→_{△}^{浓H_{2}SO_{4}}$
+CH3OH $→_{△}^{浓H_{2}SO_{4}}$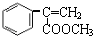 +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
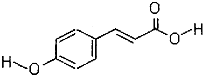
 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O;查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中 2将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向试管中滴加酚酞溶液 3将镁条投入稀盐酸中 4将铝条投入稀盐酸中 |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不是很剧烈,产生无色气体 D.有气体产生,溶液变成浅红色 |
| 实验步骤 | 实验现象 | 实验结论 |
| 5.向新制Na2S溶液中滴加新制氯水 | 产生淡黄色沉淀 | 氯气的氧化性大于硫 |
| 试剂 | 金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液 |
| 仪器 | 表面皿,试管夹,镊子,小刀,玻璃片,砂纸 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
| 实验步骤 | 实验现象 | 实验结论 |
| 5、向新制Na2S溶液中滴加新制氯水 | 产生淡黄色沉淀 | 氯的氧化性大于硫 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、[Al(OH)4]- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 操 作 | 现象 | 结论 |
| A | 将浓硫酸滴到胆矾晶体上 | 晶体逐渐变成白色 | 该过程发生物理变化 |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成蓝色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 向硝酸亚铁溶液中滴入稀硫酸 | 无明显现象 | 硝酸亚铁与硫酸不反应 |
| D | 将滴有酚酞的氨水加热 | 红色逐渐变浅 | 一水合氨受热分解,导致溶液碱性减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com