
科目: 来源: 题型:选择题
 图为金的晶胞结构示意图,若金的原子半径为r,则空间利用率的表达式为( )(金的相对原子质量为197)
图为金的晶胞结构示意图,若金的原子半径为r,则空间利用率的表达式为( )(金的相对原子质量为197)| A. | $\frac{{\frac{4}{3}π{r^3}×4}}{{{{({\frac{4}{{\sqrt{2}}}r})}^3}}}$×100% | B. | $\frac{{\frac{4}{3}π{r^3}×14}}{{{{({\frac{4}{{\sqrt{2}}}r})}^3}}}$×100% | ||
| C. | $\frac{{\frac{197}{NA}×4}}{{{{({\frac{4}{{\sqrt{2}}}r})}^3}}}$×100% | D. | $\frac{{\frac{4}{3}π{r^3}×8}}{{{{({\frac{8}{{\sqrt{3}}}r})}^3}}}$×100% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4:11 | B. | 16:9 | C. | 8:11 | D. | 32:9 |
查看答案和解析>>
科目: 来源: 题型:实验题
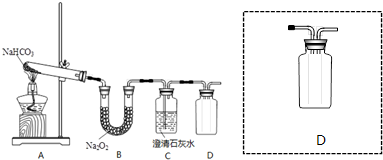
查看答案和解析>>
科目: 来源: 题型:选择题
 如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )
如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )| A. | 生石灰 | B. | 食盐 | C. | 蔗糖 | D. | 固体NH4NO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
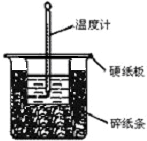 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 温度 序号 | 起始温度t1/℃ | 终止温度 T2/℃ | 温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com