
科目: 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | C(s)+CO2(g)?2CO(g) (正反应为吸热反应) | |
| C. | 2NO2(g)?N2O4(g) (正反应为放热反应) | |
| D. | 3O2(g)?2O3(g) (正反应为吸热反应) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuS<Cu(OH)2<CuCO3 | B. | CuS>Cu(OH)2>CuCO3 | C. | Cu(OH)2>CuCO3>CuS | D. | Cu(OH)2>CuCO3>CuS |
查看答案和解析>>
科目: 来源: 题型:选择题
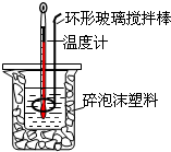
| A. | 使用环形玻璃棒既可以搅拌又避免损坏温度计 | |
| B. | 测了酸后的温度计要用水清洗后再测碱的温度 | |
| C. | 向盛装酸的烧杯中加碱时要小心缓慢以免洒出 | |
| D. | 改变酸碱的用量,所求中和热数值不变 |
查看答案和解析>>
科目: 来源: 题型:实验题
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目: 来源: 题型:实验题
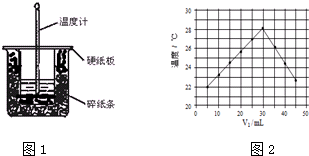
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
| 3 | 25.1 | 25.1 | 25.1 | 33.6 | 8.5 |
查看答案和解析>>
科目: 来源: 题型:实验题
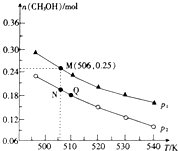 二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题.回答下列问题:
二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol•L-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol•L-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T(℃) | NO初始浓(mol•L-1) | 催化剂的比表面积(m2•g-1) | NO平衡浓度(mol•L-1) |
| 甲 | 280 | 1.80×10-3 | 82 | 0.60×10-3 |
| 乙 | 280 | 1.80×10-3 | 124 | c(乙) |
| 丙 | T(丙) | 1.80×10-3 | 124 | 0.98×10-3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 小苏打中加入过量的澄清石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 偏铝酸钠溶液中通入过量的CO2:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32- | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O | |
| D. | Fe(NO3)2溶液中加入过量的HI溶液:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com