
科目: 来源: 题型:解答题
| 操 作 | 现 象 |
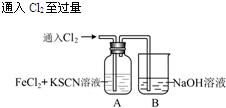 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
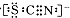
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | NaHCO3溶液中:c(OH-)+c(H2CO3)=c(H+)+c(CO32-) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
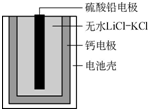 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )| A. | 该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb | |
| B. | 放电过程中,Li+向正极移动 | |
| C. | 每转移0.1mol电子,理论上生成20.7gPb | |
| D. | 常温下电解质是不导电的固体,电池不工作 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+H2O+CO2↑ | |
| C. | 用饱和纯碱溶液溶解苯酚:CO32-+2C6H5OH→2C6H5O-+H2O+CO2↑ | |
| D. | Fe(NO3)2溶液中滴加稀硫酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{34}^{78}$ See 和${\;}_{34}^{80}$ Se所含电子数不同 | |
| B. | ${\;}_{34}^{78}$ Se和${\;}_{34}^{80}$ Se是两种不同的核素 | |
| C. | ${\;}_{34}^{78}$ Se和${\;}_{34}^{80}$ Se 分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}$ Se和${\;}_{34}^{80}$ Se都含有34个中子 |
查看答案和解析>>
科目: 来源: 题型:解答题
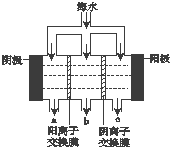 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸馏时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| B. | 定容时,如果加水超过了刻度线,可用蒸发皿蒸出少量水后重新定容 | |
| C. | 配制稀硫酸时,先在烧杯中加入一定量水,再沿玻璃棒慢慢加入浓硫酸 | |
| D. | 称量NaOH时,NaOH置于小烧杯中放在托盘天平左盘,砝码放在右盘 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸铜溶液和氢氧化钠溶液反应后的生成物 | |
| B. | 铁粉和铜粉跟稀硫酸反应后的生成物 | |
| C. | 氢氧化钠和盐酸反应后的生成物 | |
| D. | 用氯酸钾和二氧化锰的混合物加热制氧气后的剩余物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com