
科目: 来源: 题型:填空题
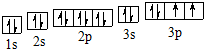 .
.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
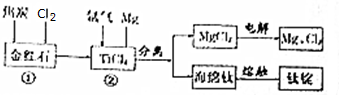
查看答案和解析>>
科目: 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | E | F | G | R | ||||
| 3 | B | C | D | H |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a=b+m+n | B. | a=b-m+n | C. | a=b+m-n | D. | a=b-m-n |
查看答案和解析>>
科目: 来源: 题型:解答题
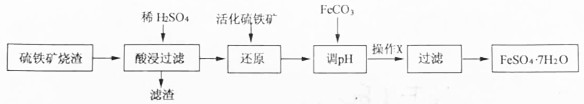
| Fe3+ | Al3+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气的热化学方程式是H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )| A. | 该反应的热化学方程式为 N2(g)+3H2(g)?2NH3(g),△H=-192kJ•mol-1 | |
| B. | 不用催化剂,生成 1molNH3放出的热量为92kJ | |
| C. | 曲线b表明加入催化剂,反应热减小 | |
| D. | 曲线b表明加入催化剂,反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com