
科目: 来源: 题型:多选题
| A. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 已知反应H2S(g)+a O2(g)═X+c H2O(l)△H,若△H表示该反应的燃烧热,则X为SO2(g) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | 植物通过光合作用将二氧化碳转化为葡萄糖是太阳能转化为热能的过程 | |
| C. | 在101kPa时,1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热 | |
| D. | 热化学方程式中的△H的值与反应物的用量有关 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
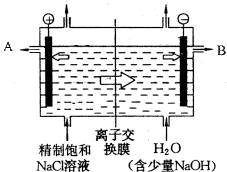 工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:
工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石墨为阴极,阳极上有气体产生 | |
| B. | 铁作阳极,阴极的反应式为2H++2e-═H2 | |
| C. | 铁作阴极,阳极的反应式为2 MnO42--2e-═2 MnO4- | |
| D. | 石墨为阳极,阴极的反应式为2 MnO42--2e-═2 MnO4- |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原电池反应一定是自发进行的氧化还原反应,且△H<0 | |
| B. | △H<0,△S<0的反应肯定能自发进行 | |
| C. | 体系能量增大和混乱度增大都有促使反应自发进行的倾向 | |
| D. | CaCO3(s)=CaO(s)+CO2(g)的△H>0,△S<0,该反应在较高温度下能自发进行 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 4FeS2( s)+11O2( g)═2Fe2O3( s)+8SO2(g)△H=-3414.8kJ•moL | |
| B. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=-853.7kJ•moL | |
| C. | 4FeS2(s)+11O2(g)═2 Fe2O3 (s)+8SO2(g)△H+3414.8kJ•moL | |
| D. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=+853.7kJ•moL |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com