
科目: 来源: 题型:选择题
| A. | 胶体是很稳定的分散系,比溶液还稳定 | |
| B. | 胶体能发生丁达尔现象 | |
| C. | 胶体的分散质不能透过滤纸 | |
| D. | 胶体不稳定,静止后容易产生沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 胶体是澄清透明的 | B. | 胶体能产生丁达尔现象 | ||
| C. | 分散质粒子直径在1nm~100nm之间 | D. | 胶体在一定条件下能稳定存在 |
查看答案和解析>>
科目: 来源: 题型:推断题
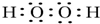 .W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
科目: 来源: 题型:解答题
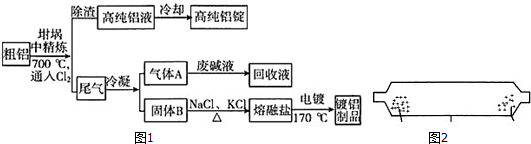
查看答案和解析>>
科目: 来源: 题型:推断题
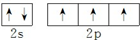 .
.查看答案和解析>>
科目: 来源: 题型:选择题
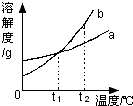
| A. | b的溶解度大于a的溶解度 | |
| B. | t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等 | |
| C. | 将t2℃时的b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液 | |
| D. | t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数 |
查看答案和解析>>
科目: 来源: 题型:解答题
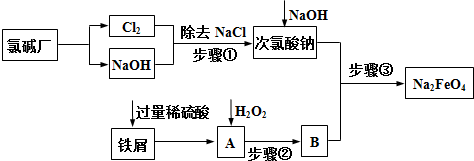
查看答案和解析>>
科目: 来源: 题型:解答题
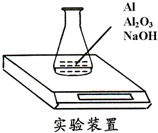 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 | 第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com