
科目: 来源: 题型:选择题
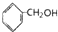
| A. | ①③ | B. | ①④⑤ | C. | ②④ | D. | ①②③⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率 | |
| B. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| C. | 合成氨是放热反应,采用在较高温度下进行反应 | |
| D. | 实验室用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A)=0.01mol•L-1s-1 | B. | v(B)=0.02mol•L-1s-1 | ||
| C. | v(C)=1.50mol•L-1min-1 | D. | v(D)=0.50mol•L-1min-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 晶格能由大到小:NaF>NaCl>NaBr>NaI | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 硬度由大到小:金刚石>晶体硅>碳化硅 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
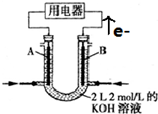
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目: 来源: 题型:解答题
 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在使用过程中,电池负极区溶液pH增大 | |
| B. | 在使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | 在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 | |
| D. | 外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com