
科目: 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)═H2O(g)△H=+44 kJ/mol,则2 g H2(g)完全燃烧生成液态水比生成气态水多释放22 kJ的能量 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H<0 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者△H小 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、蒸馏 | |
| B. | 除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液 | |
| C. | CH4和CCl4中的化学键均为非极性键,CH4、CCl4都是正四面体结构 | |
| D. | 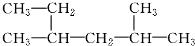 系统命名法为:2,4-二甲基-己烷 系统命名法为:2,4-二甲基-己烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | B. | MgCl2的电子式: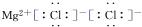 | ||
| C. | 中子数为8的碳原子:${\;}_{6}^{8}$C | D. | F-的结构示意图: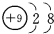 |
查看答案和解析>>
科目: 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
取100mL 18.3mol•L﹣1 的H2SO4与Zn反应,当Zn完全溶解时,生成的气体(可使品红褪色)在标准状况下的体积为22.4L.将所得的溶液稀释成1L,测得溶液H+的浓度为1mol•L﹣1,则所生成的气体中SO2与H2的体积比约为( )
A.1:2 B.2:1 C.1:4 D.4:1
查看答案和解析>>
科目: 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:填空题
氯化铜可用于生产颜料、木材防腐剂等.用粗铜(含杂质Fe)经过一系列步骤可制备氯化铜晶体(CuCl2•2H2O).完成下列填空:
(1)实验室用浓盐酸和二氧化锰共热来制备Cl2,写出该反应的离子方程式______________.
(2)加入试剂将CuCl2和FeCl3的混合溶液pH调至4~5,过滤得到纯净的CuCl2溶液,应加入的试剂是______________(填字母编号)
a.CuO b.NaOH c.Cu2(OH)2CO3 d.Cu
(3)CuCl2溶液通过蒸发、结晶可得到CuCl2•2H2O.
①蒸发过程中,加入盐酸的目的是______________.
②蒸发过程中,观察到溶液颜色由蓝色变为绿色.
其原理是: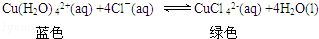
上述反应的化学平衡常数表达式是______________.
欲使溶液由绿色变成蓝色的措施是:a__________;b__________.
查看答案和解析>>
科目: 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:实验题
利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品﹣3PbO•PbSO4•H2O (三盐),主要制备流程如下:

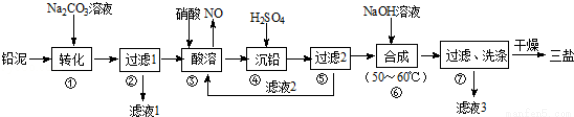
(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为______________.
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为______________(写化学式).
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为______________;滤液2中溶质主要成分为______________(写化学式).
(4)步骤⑥合成三盐的化学方程式为______________.
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是______________.
查看答案和解析>>
科目: 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:实验题
某 校化学研究性学习小组查阅资料了解到以下内容:
校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为______________.
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去 ,请配平该反应的离子方程式:
,请配平该反应的离子方程式:
______MnO4﹣+______ H2C2O4+______ H+═______ Mn2++______ CO2↑+______ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):
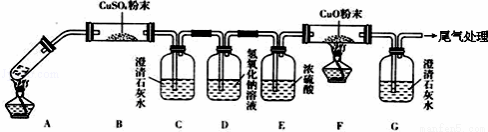
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红 色.据此回答:
色.据此回答:
上述装置中,D的作用是_________.乙二酸分解的化学方程式为_________.只根据G中澄清石灰水变浑浊能否得出“草酸分解产物中一定有CO”的结论_________(填“ 能或不能”)
能或不能”) 若不能应怎样改进?______________.
若不能应怎样改进?______________.
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化).则下列关系合理的是_________
A.c(Na+)+c(H+)=c(HC2O4﹣)+c(OH﹣)+c(C2O42﹣)
B.c(HC2O4﹣)+c(C2O42﹣)=0.2mol•L ﹣1
﹣1
C.c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
D.c(Na+)=c(H2C2 O4)+c(HC2O4﹣)+c(C2O42﹣)
O4)+c(HC2O4﹣)+c(C2O42﹣)
查看答案和解析>>
科目: 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:填空题
前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为____________.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为_______________(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
微粒 | EO2﹣ | EO3﹣ |
立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是____________.
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为____________,δ、γ、α三种晶胞的边长之比为____________。
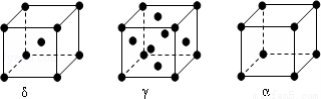
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com