
科目: 来源: 题型:解答题
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量/g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | 20 | 不加 | 20 | 20 | 2.0050 | ﹨ |
| ④ | t2 | 5mL0.01mol•L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
查看答案和解析>>
科目: 来源: 题型:解答题
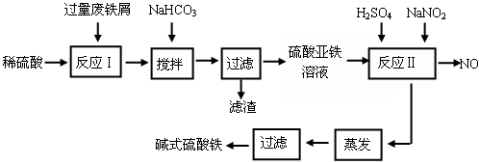
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
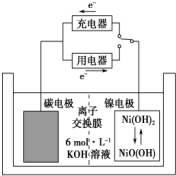 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )| A. | 充电时阴极反应:2H2O+2e-═2OH-+H2↑ | |
| B. | 充电时将碳电极与电源的负极相连 | |
| C. | 放电时,OH-移向碳电极 | |
| D. | 放电时镍电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
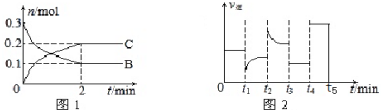
| A. | x=2.反应开始2min内,v(A)=0.05 mol•L-1•min-1 | |
| B. | 若tl时改变的条件是降温,平衡正向移动,则该反应为放热反应 | |
| C. | 若t2时改变的条件是增大c的浓度,则t2时正反应速率减小 | |
| D. | t3-t5时间段B的浓度一定未发生变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度,可使单位体积内活化分子数增多,反应速率加快 | |
| B. | 已知:C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3 kJ/mol,△S=+133.7 kJ/mol则该反应在低温下能自发进行 | |
| C. | 将FeCl3的水溶液加热蒸干可得到FeCl3固体 | |
| D. | 使用催化剂可降低反应的△H和反应的活化能,从而提高化学反应速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ②③④⑤⑥ | D. | ①②④⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子最外层有3个电子的一种金属 | |
| B. | 熔点低于100℃的一种金属 | |
| C. | 次外电子层上有8个电子的一种元素 | |
| D. | 除最外层,原子的其他电子层电子数目均达饱和的一种金属 |
查看答案和解析>>
科目: 来源: 题型:实验题
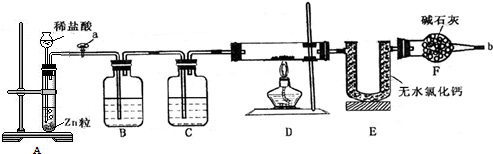
查看答案和解析>>
科目: 来源: 题型:推断题
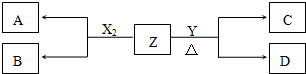
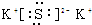 ,D的水溶液pH>7(填“=”、“>”或“<”.
,D的水溶液pH>7(填“=”、“>”或“<”.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com