
科目: 来源: 题型:填空题
| 原子半径 | 电负性 |
| Al>Si | N<O |
查看答案和解析>>
科目: 来源: 题型:实验题
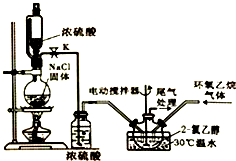 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.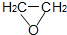 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 30% | B. | 20% | C. | 40% | D. | 35% |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | NaCl、NaOH、NH4NO3、CaCO3 | B. | FeCl3、CuSO4、Mg(OH)2、NaCl | ||
| C. | BaSO4、AgCl、KOH、NH4Cl | D. | NH4HCO3、MgCl2、BaCl2、Ba(NO3)2 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | MgSO4═Mg+2+SO4-2 | B. | Ba(OH)2═Ba2++(OH-)2 | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | Ca(NO3)2═Ca2++2NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
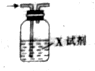 已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )| A. | NaOH溶液 | B. | 浓硫酸 | C. | Na2CO3溶液 | D. | NaHCO3溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 起始浓度(mol•L-1) | 甲 | 乙 | 丙 |
| C(I2) | 0.1 | 0.2 | 0.2 |
| C(I-) | 0.2 | 0.1 | 0.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com