
科目: 来源: 题型:选择题
| A. | 乙醛 | B. | 甲醛 | C. | 丙醛 | D. | 丁醛 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C4H8、C3H6 | B. | C2H2、C3H8 | C. | C2H4、C3H6 | D. | C2H6、C3H6 |
查看答案和解析>>
科目: 来源: 题型:选择题
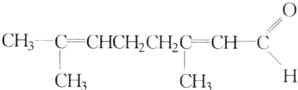 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )| A. | 可使酸性高锰酸钾溶液褪色 | B. | 可跟银氨溶液反应生成银镜 | ||
| C. | 可使溴水褪色 | D. | 催化加氢后最终产物是C10H20O |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用. | / |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤. | / |
| 步骤3:取少量步骤2得到的滤渣,加入盐酸. | |
| 步骤4: | |
| 步骤5: |
查看答案和解析>>
科目: 来源: 题型:实验题
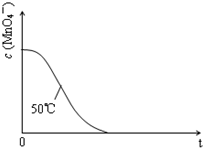 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案. | 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目: 来源: 题型:实验题
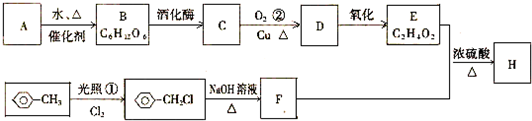
 ,
,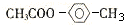 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 钢板是正极,正极上发生还原反应 | |
| B. | 放电时电子的流向:正极→导线→负极 | |
| C. | 放电时OH-向正极移动 | |
| D. | 放电时总反应为:4Li+2H2O+O2=4LiOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “84”消毒液的水溶液中:Fe2+、Cl-、H+、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、S2- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com