
科目: 来源: 题型:推断题
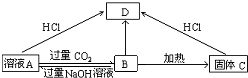
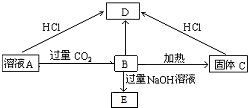
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | Z | |
| A | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B | Fe粉 | A1粉 | HC1溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | C12 |
| D | FeCl2溶液 | CuCl2 | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
查看答案和解析>>
科目: 来源: 题型:解答题
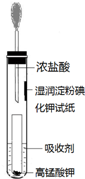 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4查看答案和解析>>
科目: 来源: 题型:推断题
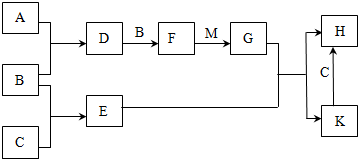
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a可能等于b | B. | a一定大于b | C. | a可能大于b | D. | a一定等于b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com