
科目: 来源: 题型:解答题
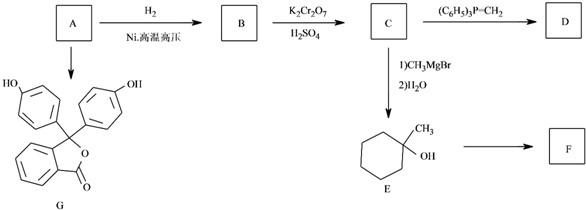
 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
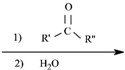
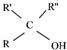
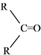
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$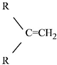 (R表示烃基,R′和R″表示烃基或基)
(R表示烃基,R′和R″表示烃基或基) .
. 、
、 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
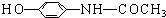 下列关于该物质的描述,不正确的是( )
下列关于该物质的描述,不正确的是( )| A. | 该化合物分子式为C8H9O2N | |
| B. | 能和银氨溶液发生银镜反应 | |
| C. | 能和氢氧化钠发生反应 | |
| D. | 其分子中的原子不可能都在同一平面上 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | R有多种氧化物 | B. | R的气态氢化物很稳定 | ||
| C. | R的非金属性比Cl的非金属性强 | D. | R的最高价氧化物的水化物是强碱 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com