
科目: 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 向100mL 1mol/L FeBr2溶液中通入0.5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:推断题
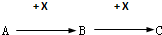
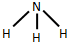
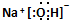 .
. ,写出A生成B的反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,写出A生成B的反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
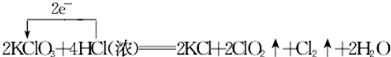 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素B的化合物可以用来做焰火材料 | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素B、D的最高价氧化物对应的水化物之间可能发生反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 漂白粉溶液中通入SO2气体 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO3-+OH-═CO32-+H2O | |
| C. | 明矾溶液中加入过量的Ba(OH)2溶液2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 过量的NH4HSO4溶液与Ba(OH)2溶液反应2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
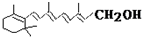 ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )| A. | 维生素A的分子式为C20H32O | |
| B. | 维生素A不能使溴的四氯化碳溶液褪色 | |
| C. | 该有机物能发生取代反应 | |
| D. | 1mol维生素A 在催化剂作用下最多可与7molH2发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由于D、C、E元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| B. | 元素D和E的某些单质不可以作为水处理中的消毒剂 | |
| C. | 元素B的单质只能与氢氧化钠溶液反应而不能与任何酸反应 | |
| D. | A、E两种元素能形成A2E和A2E2型化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.8 g的NH4+离子中含有的电子数为0.1NA | |
| B. | 1mol Na2O2 固体中含离子总数为4NA | |
| C. | 标准状况下,2.24L CCl4所含的共价键数为O.4NA | |
| D. | 常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com