
科目: 来源: 题型:解答题
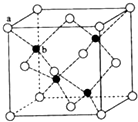 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaHSO3溶液中通入NH3至中性,溶液中存在:c(NH4+)>c(SO32-) | |
| B. | NH4Cl和NH3•H2O混合液pH=7,一定存在:c(NH4+)>c(Cl-) | |
| C. | NAHCO3溶液中存在HCO3-+H2O═H3O++CO32-,加水稀释后c(H+)减小 | |
| D. | pH相同的氯化铵与硫酸亚铁铵两种溶液中铵根离子浓度前者大 |
查看答案和解析>>
科目: 来源: 题型:选择题
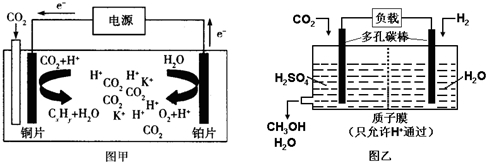
| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| A | 向少量燃尽火柴头的浸泡液中滴加稀硫酸,AgNO3 | 验证火柴头含有氯元素 |
| B | 向两支装有等体积,等浓度的H2O2溶液试管中分别加入1mol等浓度的FeCl3溶液、CuSO4溶液 | 催化效果:Fe3+>Cu2+ |
| C | 向待测溶液中加NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝的气体 | 证明原溶液中含有NH4+ |
| D | 向等浓度的NaCl、KI混合液中逐滴加入AgNO3溶液先出现黄色沉淀 | K(sp),AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 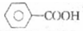 的同分异构体中能发生银镜反应的芳香族化合物有4种 的同分异构体中能发生银镜反应的芳香族化合物有4种 | |
| B. | 纤维素在人体中水解的最终产物是葡萄糖 | |
| C. | 烷烃与聚乙烯结构中均有碳碳单键 | |
| D. | 0.1mol 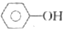 和 和 的混合物完全燃烧消耗O215.68L 的混合物完全燃烧消耗O215.68L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 11.2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| C. | 300ml2mol•L-1蔗糖溶液中所含分子数为0.6NA | |
| D. | 标准状况下,30g乙酸和甲醛的混合物中氧原子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用SiO2的导电性来制备光导纤维 | |
| B. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油 | |
| C. | “地沟油”不能食用,但可以加工成肥皂或生物柴油 | |
| D. | 发展新能源汽车的主要目的是为了减少PM2.5的排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
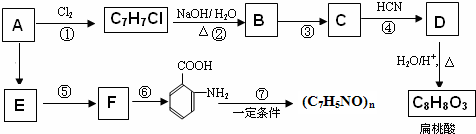
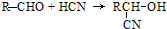
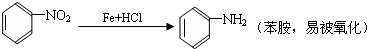
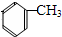 ;扁桃酸
;扁桃酸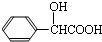 .
. .
. .
.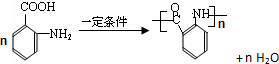 .
.查看答案和解析>>
科目: 来源: 题型:解答题
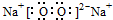 .
.
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 10Fe2++8I-+4Br-+11Cl2→10Fe3++4I2+2Br2+22Cl- | |
| B. | 2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- | |
| C. | 6Fe2++4I-+5Cl2→6Fe3++2I2+10Cl- | |
| D. | 6Fe2++2I-+6Br-+7Cl2→6Fe3++I2+3Br2+14Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com