
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等于NA | B. | 小于NA | C. | 大于NA | D. | 等于NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液的pH增大,有O2放出 | B. | 溶质质量分数增大,有O2放出 | ||
| C. | 溶液c(Na+)增大,有O2放出 | D. | 溶液n(Na+)减小,有O2放出 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若1mol•L-1HF溶液中H+数目为NA,则等体积的2mol•L-1HF溶液中H+数目为2NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36g3H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 280.58kJ | B. | 562.76kJ | C. | 530.58kJ | D. | 890.3kJ |
查看答案和解析>>
科目: 来源: 题型:解答题
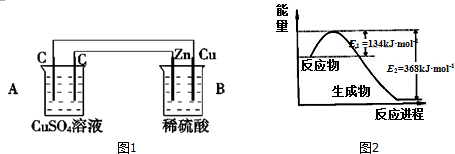
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁在潮湿的空气中易腐蚀 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | 往往需要在催化剂条件下SO2氧化成SO3 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该电池又称纽扣电池,是可充电池,适用于大电流连续放电 | |
| B. | 该电池属于碱性电池,放电过程中,锌失去电子生成锌离子,向负极移动 | |
| C. | 该电池在放电过程中,正极的pH变大 | |
| D. | 该电池的负极反应式:Zn-2e-=Zn2+ |
查看答案和解析>>
科目: 来源: 题型:实验题
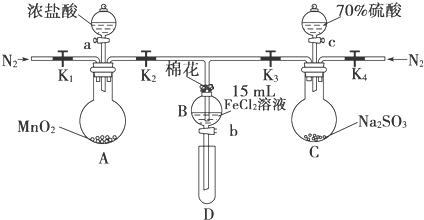
| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com