
科目: 来源: 题型:解答题
 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中. $\stackrel{室温}{→}$
$\stackrel{室温}{→}$ ,反应类型为加成;该反应的产物除
,反应类型为加成;该反应的产物除 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式 ;
; )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.查看答案和解析>>
科目: 来源: 题型:解答题
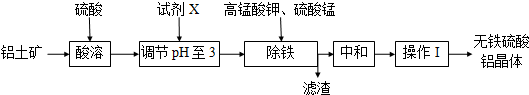
| 开始 | 完全 | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.3 | 5.0 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
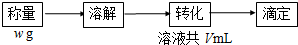
查看答案和解析>>
科目: 来源: 题型:解答题
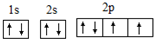 ;氧元素原子核外有3种不同能级的电子;
;氧元素原子核外有3种不同能级的电子;查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 剩余的5.44g金属为铁 | B. | 剩余5.44g金属为铜 | ||
| C. | 共生成NO气体 0.03mol | D. | 8.08g金属中铁的质量分数为20.8% |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 原氨水中有1%的含氮微粒为NH4+ | |
| C. | 反应后的溶液呈酸性 | |
| D. | 混合溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=5×10-4mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在20g D2O中含有NA个氧原子 | |
| B. | 标准状况下,2.24 L三氧化硫中所含氧原子数为0.3 NA | |
| C. | 1 molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定Na2CO3、Na2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 | 比较盐酸、醋酸的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用醋酸除去水垢:2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑ | |
| B. | 硫酸铁溶液中通入硫化氢气体:2Fe3++3H2S→2FeS↓+S↓+6H+ | |
| C. | 铝与氢氧化钠溶液反应:Al+2OH-→AlO2-+H2↑ | |
| D. | 已知25℃时,电离常数Ki (苯甲酸)>Ki1(H2CO3)>Ki (苯酚)>Ki2(H2CO3).常温下将水杨酸(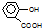 )与过量的Na2CO3溶液混合: )与过量的Na2CO3溶液混合: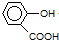 +2CO32-→ +2CO32-→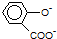 +2HCO3- +2HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化铝能溶于强碱溶液 | B. | 铝片能与盐酸反应生成氢气 | ||
| C. | 氯化铝溶液显酸性 | D. | 铝能发生铝热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com