
科目: 来源: 题型:实验题

| 金 属 | 熔点(℃) | 沸点(℃) |
| 钙 | 841 | 1 487 |
| 镧 | 920 | 3 470 |
查看答案和解析>>
科目: 来源: 题型:实验题
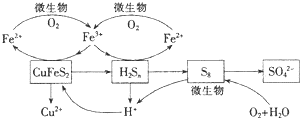
查看答案和解析>>
科目: 来源: 题型:
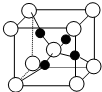 硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
查看答案和解析>>
科目: 来源: 题型:解答题
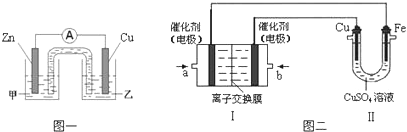
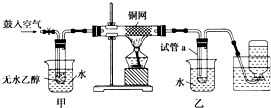 某实验小组用下列装置进行乙醇催化氧化的实验.
某实验小组用下列装置进行乙醇催化氧化的实验.查看答案和解析>>
科目: 来源: 题型:实验题
 图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.
图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.查看答案和解析>>
科目: 来源: 题型:解答题
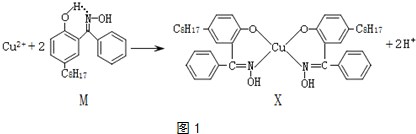
| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
查看答案和解析>>
科目: 来源: 题型:选择题
 对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )
对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )| A. | 电解时Pt电极应与直流电源的负极相连 | |
| B. | 电解时Pt电极上有H2放出 | |
| C. | 阴极反应式为:C6H5NO2+4e-+4H+═HOC6H4NH2+H2O | |
| D. | 电解一段时间后,硫酸溶液的pH不变化 |
查看答案和解析>>
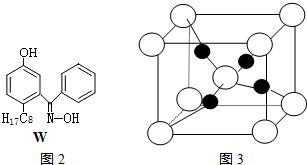
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 由CuFeS2生成Cu2S,SO2和铁的氧化物反应中硫元素被还原 | |
| B. | 熔炼过程中的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 铜的电解精炼过程中纯铜做阳极 | |
| D. | 上述冶炼过程产生大量SO2,通常用饱和NaHSO3溶液吸收 |
查看答案和解析>>
科目: 来源: 题型:多选题
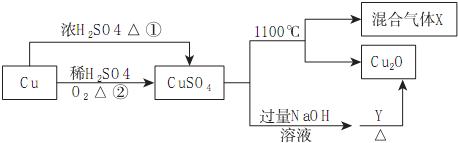
| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是乙醛溶液 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com