
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:12C | B. | 氮气的电子式: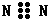 | ||
| C. | Cl-离子的结构示意图: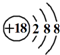 | D. | NaCl的电子式: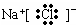 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为“0.8 mol•L-1•s-1”所表示的意思是:时间为1 s时,某物质的浓度为0.8 mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应现象越明显,反应速率越大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学键既存在于相邻原子之间,也存在于相邻分子之间 | |
| B. | 两个原子之间的相互作用叫化学键 | |
| C. | 化学键通常指的是直接相邻的原子或离子之间的强烈的相互作用 | |
| D. | 离子键是阴、阳离子通过静电引力而形成的化学键 |
查看答案和解析>>
科目: 来源: 题型:解答题



 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种. (任写一种)(任写一种).
(任写一种)(任写一种).查看答案和解析>>
科目: 来源: 题型:解答题
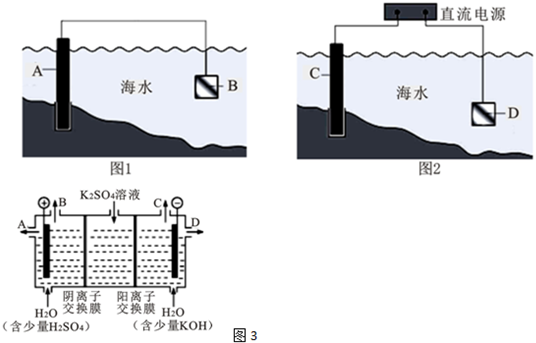
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com