
科目: 来源: 题型:选择题
| A. | 向水中加少量NaHSO4 | B. | 向水中加少量FeCl3 | ||
| C. | 向水中加少量Na2CO3 | D. | 将纯水加热到90℃ |
查看答案和解析>>
科目: 来源: 题型:实验题
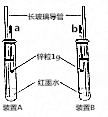 某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象.
某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5mol•L-1•min-1 | B. | 1 mol•L-1•min-1 | ||
| C. | 4 mol•L-1•min-1 | D. | 2 mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:实验题
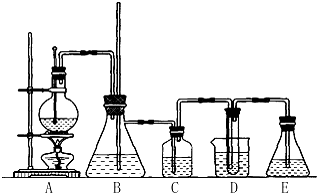
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,28g氮气的体积约为22.4升 | |
| B. | 标准状况下,11.2L水含有1mol氢原子 | |
| C. | 标准状况下,11.2L氧气与硫充分反应,转移的电子数目为2NA | |
| D. | 常温常压下,1mol氯气完全被碱吸收需要NA个氢氧根离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 非金属性:P<S<Cl | B. | 氢化物稳定性:HF>H2S>H2O | ||
| C. | 碱性:Mg(OH)2>NaOH>Ca(OH)2 | D. | 原子半径:F>Cl>Br>I |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com