
科目: 来源: 题型:选择题
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | 根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

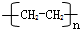 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锌锰干电池电极总反应为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+H2O,则正极反应为:2MnO2+2H++2e-=Mn2O3+H2O | |
| B. | 将1mol过氧化钠投入含有1molAlCl3的溶液中:6Na2O2+6H2O+4Al3+=4Al(OH)3↓+3O2↑+12Na+ | |
| C. | NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20 H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溴水中:Na+、K+、SiO32-、CO32- | |
| B. | pH=13的溶液:Ba2+、Na+、I-、ClO- | |
| C. | 苯酚钠溶液中:HSO3-、K+、Na+、AlO2- | |
| D. | 加入淀粉碘化钾溶液显蓝色:Na+、NH4+、SO42-、CH3COO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7.2g | B. | 5.4g | C. | 3.6g | D. | 2.7g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④⑤ | C. | ②③④⑥ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com