
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
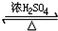 CH3COOCH2CH3+H2O已知:乙醛可氧化为乙酸(该方程式不用写)
CH3COOCH2CH3+H2O已知:乙醛可氧化为乙酸(该方程式不用写)查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子是Zn2+ | |
| C. | 当有第三种单质生成时,消耗的锌粉质量至少大于13 g | |
| D. | 反应结束时,可得到0.25 mol ZnSO4 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃 | |
| B. | 将l mol Mg置于10 L空气(标况)中,使之在高温下反应 | |
| C. | 标准状况下,将11.2L H2S与22.4L O2混合点燃 | |
| D. | 在强光持续照射下,向过量的Ca(ClO)2的悬浊液中通入少量CO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属与盐溶液的反应都是置换反应 | |
| B. | 阴离子都只有还原性 | |
| C. | 离子化合物中肯定存在离子键,可能不存在共价键 | |
| D. | 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 |
查看答案和解析>>
科目: 来源: 题型:解答题
 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)查看答案和解析>>
科目: 来源: 题型:选择题
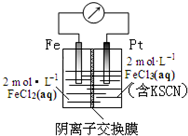
| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e?=Fe | |
| D. | 若转移1mol e-,交换膜左侧溶液中则减少1 molCl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在50g质量分数为46%的乙醇水溶液中,含有氢原子数为3NA | |
| B. | 15.6g Na2S和Na2O2固体混合物中,含有的阴离子数为0.2NA | |
| C. | 1L 1mol/L的盐酸中含有HCl分子数为NA | |
| D. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com