
科目: 来源: 题型:选择题

| A. | 冰毒的摩尔质量为149 | |
| B. | 海洛因和杜冷丁均能与溴水发生加成反应 | |
| C. | 1mol可卡因最多能与2molNaOH发生反应 | |
| D. | 以上毒品均属于芳香烃 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 步骤 | 实验方案 | 预期现象和结论 |
| ① | 用药匙取少许样品粉末,加入试管A中,再用胶头滴管取过量的NaOH溶液加入试管A中,充分反应后,静置.弃去上层清液,剩余固体备用. | 粉末部分溶解,并有气体放出,则合金中一定含有铝 |
| ② | 向试管A的剩余固体中加入过量的稀硫酸充分反应后,静置,取上层清液于试管B中,剩余固体备用. | 固体部分溶解,并有气体放出,溶液呈浅绿色,则合金中可能含有 铁. |
| ③ | 在试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变成黄色,加KSCN后显血红色,结合②可知,一定含铁 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色沉淀产生,则合金中一定含有铜. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H、Na、S、Cl、N | B. | H、Na、S、Br、P | C. | H、Li、O、F、N | D. | H、Mg、S、O、N |
查看答案和解析>>
科目: 来源: 题型:解答题
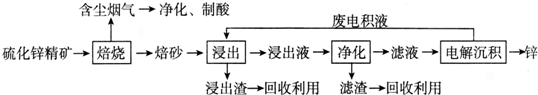
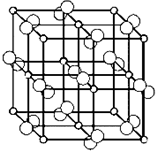 四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位.回答下列问题:
四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
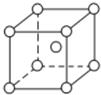 已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目: 来源: 题型:推断题
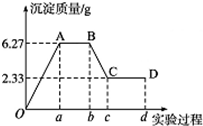 下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示:
下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示:查看答案和解析>>
科目: 来源: 题型:实验题
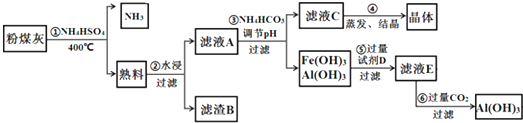
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
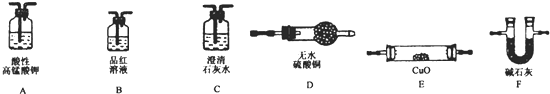
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com