
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原混合物中铜和铁各0.15mol | |
| B. | 第一次剩余9.6g金属为铜和铁 | |
| C. | 稀硝酸的物质的量浓度为2.0mol/L | |
| D. | 向反应后的溶液中再加入该硝酸200mL,又得到标准状况下的NO体积小于2.24L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溴化亚铁溶液中滴加少量氯水:2Br-+Cl2=Br2+2Cl- | |
| B. | NH4HCO3溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| C. | NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅是光导纤维的主要成分 | |
| B. | 氢氟酸具有强酸性,可用于蚀刻玻璃 | |
| C. | 碳纤维是一种新型有机高分子材料 | |
| D. | 硅胶可做药品和食品的干燥剂 |
查看答案和解析>>
科目: 来源: 题型:推断题
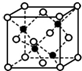 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在电池反应过程中,SO42-向带正电荷的正极移动 | |
| B. | 随着反应的进行正极区域附近pH变小 | |
| C. | 当转移4mol电子时,溶液中CH3COOH分子个数为NA | |
| D. | 负极的电极反应方程式为CH2=CH2-4e-+2H2O═CH3COOH+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com