
科目: 来源: 题型:推断题
 A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:查看答案和解析>>
科目: 来源: 题型:解答题
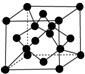 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
查看答案和解析>>
科目: 来源: 题型:实验题

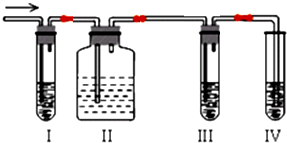
查看答案和解析>>
科目: 来源: 题型:解答题
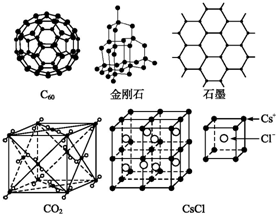
查看答案和解析>>
科目: 来源: 题型:解答题
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| T | 基态原子2p能级有3个单电子 |
| W | 基态原子p轨道上成对电子数等于未成对电子数 |
| X | 氢化物常用于刻蚀玻璃 |
| Y | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| Z | 原子序数等于X与Y的原子序数之和 |
查看答案和解析>>
科目: 来源: 题型:解答题
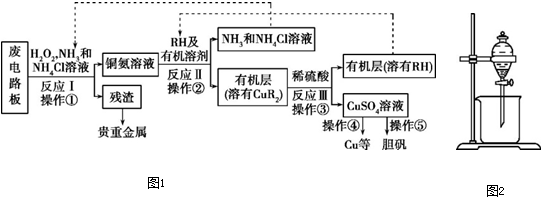
查看答案和解析>>
科目: 来源: 题型:解答题
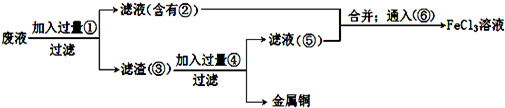
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
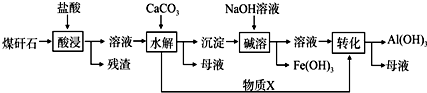
 .该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.
.该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.查看答案和解析>>
科目: 来源: 题型:填空题

| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com