
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.062 mol/L | B. | 0.62 mol/L | C. | 6.2mol/L | D. | 62mol/L |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 体积大小:③>②>① | B. | 原子数目:③>①>② | C. | 密度大小:②>③>① | D. | 质量大小:②>③>① |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等质量的H2S和PH3含有相同的原子数 | |
| B. | NH3的摩尔质量为17 | |
| C. | 9.03×1023个CO2分子的质量为66g | |
| D. | 同温同压下,相同体积的物质,其物质的量一定相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
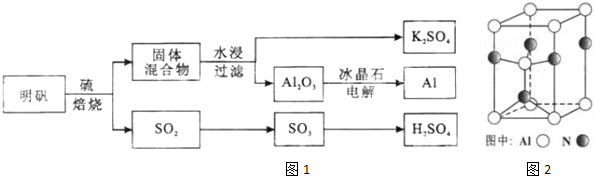
查看答案和解析>>
科目: 来源: 题型:推断题

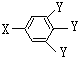
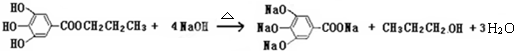
查看答案和解析>>
科目: 来源: 题型:实验题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液呈血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入K3[Fe(CN)6]溶液,振荡 | 产生蓝色沉淀 | 存在Fe2+ |

| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol K2O2中含有的阴、阳离子总数是4NA | |
| B. | 0.2molO3与6.72LO2均含有0.6NA个氧原子 | |
| C. | 常温常压下,22g P4O6与P4O10的混合物中含有氧原子的数目为0.6NA | |
| D. | 10gD216O所含的中子数为5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com