
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
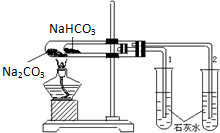 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
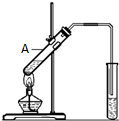 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目: 来源: 题型:填空题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
查看答案和解析>>
科目: 来源: 题型:填空题
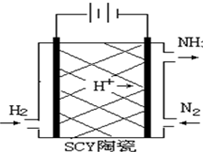 科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.
科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
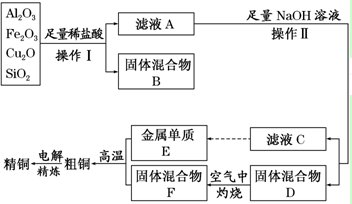
查看答案和解析>>
科目: 来源: 题型:解答题
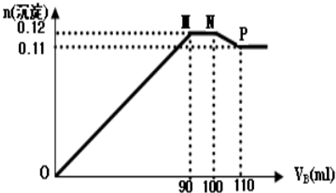
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com