
科目: 来源: 题型:选择题
| A. | 分子式分别为C2H6O、C3H8O的有机物一定互为同系物 | |
| B. | 若有机物甲和乙为同分异构体,则甲和乙的化学性质相似 | |
| C. | 某有机物燃烧只生成物质的量之比为1:2的CO2和H2O,说明其最简式为CH4 | |
| D. | 丙烯(CH2=CHCH3)易发生加成反应,一定条件下也可能取代反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
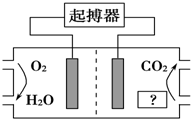 如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )
如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )| A. | 图中“?”为人体中的脂肪 | |
| B. | O2极为心脏起搏器的负极 | |
| C. | 产生的CO2使人体血液呈酸性,长期使用对人体有害 | |
| D. | 电池正极的电极反应式为O2+4H++4e-═2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l),△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数不相同 | |
| C. | 若用标准状况下4.48L CH4 还原NO2至N2,放出的热量为173.4kJ | |
| D. | 若用标准状况下4.48L CH4 还原NO2至N2,整个过程中转移的电子总数为0.8mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓烧碱溶液中加入铝片:Al+2OH-═AlO2-+H2↑ | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在2 mol/L FeBr2溶液80 mL中通入4.48 L氯气(标况下),充分反应:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+、Fe3+、SO42-、I- | B. | Na+、NH4+、CO32-、NO3- | ||
| C. | Ag+、K+、Cl-、SO42- | D. | K+、AlO2-、Cl-、HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
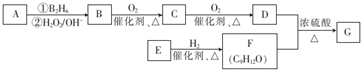
 ;该反应的反应类型为取代反应或酯化反应
;该反应的反应类型为取代反应或酯化反应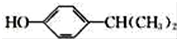 .
.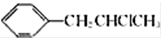 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):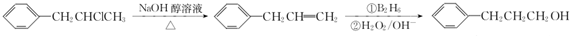 .
.查看答案和解析>>
科目: 来源: 题型:解答题
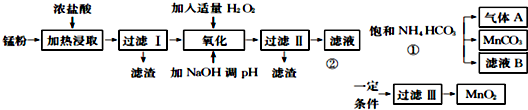
| 氢氧化物 | Fe(OH) | Fe(OH) | Mn0H)2 | Zn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.2 | 8.8 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
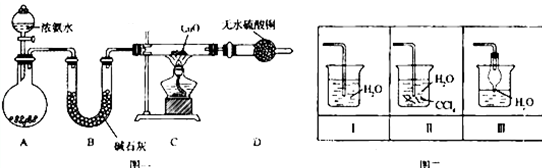
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com