
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
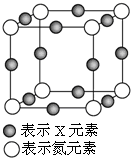 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )
元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )| A. | X元素的原子序数为28 | |
| B. | 晶体中与一个N3-距离最近的Xn+为8个 | |
| C. | Xn+中n的值为1 | |
| D. | 该晶体中N3-与Xn+的个数比为3:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
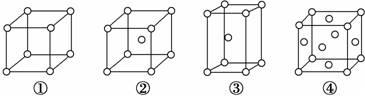
| A. | ②为六方最密堆积,③为体心立方堆积 | |
| B. | ③和④的配位数都是12 | |
| C. | 完全属于④的金属原子数为6个 | |
| D. | ③的空间利用率小于④ |
查看答案和解析>>
科目: 来源: 题型:实验题
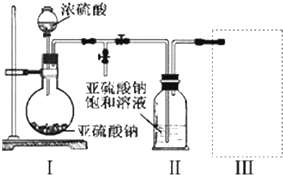
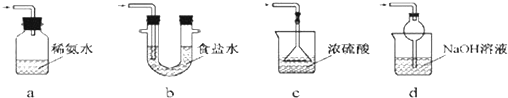

查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 不能由黑色沉淀转化为白色沉淀 | D. | 只有氯化银白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:填空题
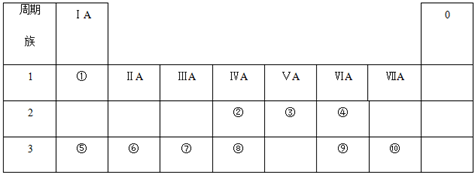
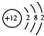
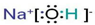
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com