
科目: 来源: 题型:解答题
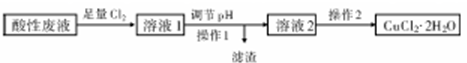
 Cu(OH)2+2H+,增大氢离子浓度,抑制Cu2+水解(结合离子方程式并简要说明).
Cu(OH)2+2H+,增大氢离子浓度,抑制Cu2+水解(结合离子方程式并简要说明).查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 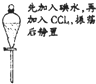 实验:液体分层,上层呈紫红色 | |
| B. | 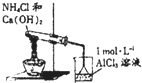 实验:烧杯中先出现白色沉淀,后溶解 | |
| C. | 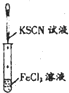 实验:试管中溶液颜色变为血红色 | |
| D. | 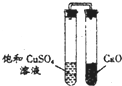 实验:放置一段时间后,饱和CuSO4溶液中出现白色晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Zn粉中含少量的ZnO:加入足量稀H2SO4充分反应后过滤 | |
| B. | Cu(NO3)2溶液中含少量AgNO3:加入足量Cu屑充分反应后过滤 | |
| C. | Na2SO4溶液中含少量H2SO4:加入足量Ba(OH)2充分反应后过滤 | |
| D. | CaCO3固体中含少量Na2CO3:加入足量稀HCl充分反应后过滤 |
查看答案和解析>>
科目: 来源: 题型:选择题
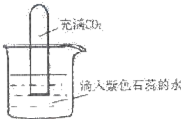 如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )| A. | ①② | B. | ①④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用水鉴别炭粉和二氧化锰 | |
| B. | 用闻气味的方法鉴别白酒和白醋 | |
| C. | 用澄清石灰水鉴别氮气和二氧化碳 | |
| D. | 用相互刻画的方法鉴别黄铜片和铜片 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+ | |
| B. | 用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 | |
| C. | 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+ | |
| D. | 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com