
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:填空题
| 组 分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
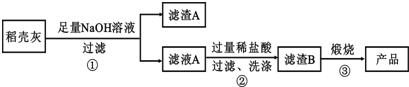
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol/LNa2S液中:c(OH-)-c(HS-)-c(H+)=2c(H2S) | |
| B. | 0.2mol/L的NH3•H2O溶液和0.1mol/LHCl溶液等体积混合(pH>7):c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| C. | 0.1mol/L pH=7.8的NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 0.1mol/L Na2SO3溶液与0.1mol/L NaHSO3溶液等体积混合:2c(Na+)-3c(SO32-)=3c(HSO3-)+3c(H2SO3) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | vA=0.15mol•L-1•min-1 | B. | vB=0.6mol•L-1•min-1 | ||
| C. | vC=0.35mol•L-1•min-1 | D. | vD=0.02mol•L-1•s-1 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锂盐 | B. | 钠盐 | C. | 钙盐 | D. | 铜盐 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②⑤ | C. | ②⑤⑥ | D. | ①④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com