
科目: 来源: 题型:实验题
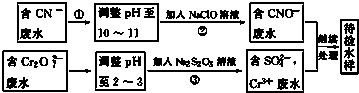
查看答案和解析>>
科目: 来源: 题型:实验题
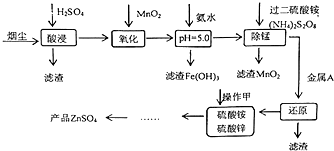 高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.3 mol•L-1 的NH4NO3溶液中含有的NO-3数目为0.3NA | |
| B. | 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA | |
| C. | 将标准状况下11.2L的Cl2通入足量水中,转移的电子总数为0.5NA | |
| D. | 一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氘(D)原子核外有1个电子 | |
| B. | H与D互称同位素 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 1H218O与D216O的相对分子质量相同 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:解答题
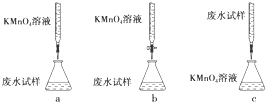
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
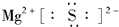 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com