
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
 某兴趣小组设计出如图装置(气密性已检查),验证铜与稀硝酸反应的产物,已知:FeSO4+NO═[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.
某兴趣小组设计出如图装置(气密性已检查),验证铜与稀硝酸反应的产物,已知:FeSO4+NO═[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X的正反应速率是Y的逆反应速率的$\frac{m}{n}$倍 | |
| B. | 通入稀有气体使压强增大,平衡将正向移动 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
查看答案和解析>>
科目: 来源: 题型:推断题
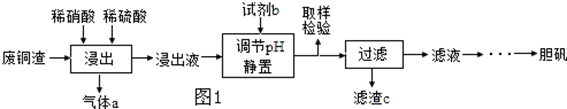
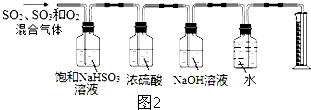
查看答案和解析>>
科目: 来源: 题型:推断题
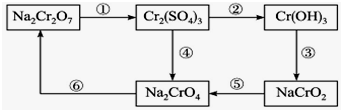 铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图:
铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图:查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
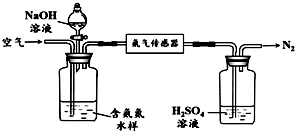

查看答案和解析>>
科目: 来源: 题型:推断题
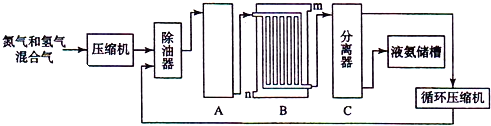
查看答案和解析>>
科目: 来源: 题型:选择题
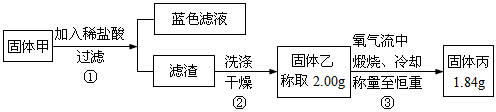
| A. | 加盐酸有蓝色溶液生成,说明固体甲中一定含有氧化铜 | |
| B. | 步骤①所得滤渣中肯定含有单质铜 | |
| C. | 固体甲中若存在Cu2O,也可能有Cu2S | |
| D. | 固体甲中,CuS和Cu2S不能同时存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com