
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 少量钠保存在汽油中 | |
| B. | 固态碘盛放在细口玻璃瓶中 | |
| C. | 液溴保存在加有少量水的盖有玻璃塞的棕色细口瓶中 | |
| D. | 浓硝酸盛放在盖有橡胶塞的棕色瓶中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 分类组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | CaF2 | Na2O2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题
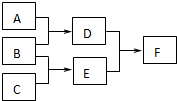 单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系:(有部分反应物或者生成物未标出)
单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系:(有部分反应物或者生成物未标出)查看答案和解析>>
科目: 来源: 题型:实验题
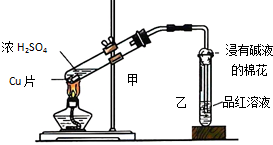 实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题:
实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com