
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
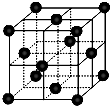 尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].
尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].查看答案和解析>>
科目: 来源: 题型:阅读理解

查看答案和解析>>
科目: 来源: 题型:
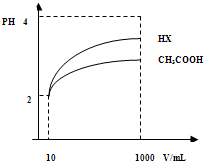
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
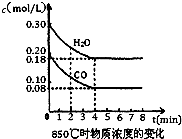 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.| 1 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com