
科目: 来源: 题型:解答题
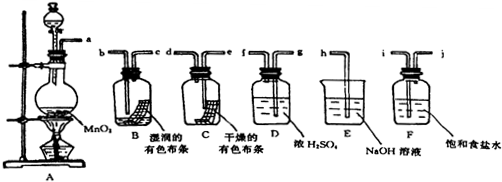
查看答案和解析>>
科目: 来源: 题型:实验题
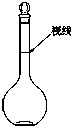 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目: 来源: 题型:实验题
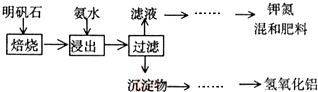
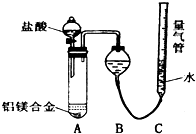 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.查看答案和解析>>
科目: 来源: 题型:解答题
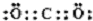 ,属于两性氢氧化物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.
,属于两性氢氧化物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | [M1-$\frac{M}{{M}_{2}}$-M]×29 | B. | [M2-$\frac{M}{{M}_{1}}$-M]×29g/mol | ||
| C. | [M2-$\frac{M}{{M}_{1}}$-M]×29 | D. | [M1-$\frac{M}{{M}_{2}}$-M]×29 g/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5d | B. | 6d | C. | 7d | D. | 8d |
查看答案和解析>>
科目: 来源: 题型:解答题
| 硫酸亚铁片 英文名:Ferrous Sulfate Tablets 本品含硫酸亚铁(FeSO4•7H2O)应为标示量的95.0%~110.0% | 氢氧化铝片 英文名:Aluminium Hydroxide Tablets |
| 【主要成分】糖衣、碳酸镁、氢氧化铝、淀粉 | |
| 【性状】本品为糖衣,除去糖衣后显淡绿色 | 【适应症】能缓解胃酸过多 |
| 【鉴别】取本品,除去糖衣,称取适量(约相当于硫酸亚铁片0.2g),加稀盐酸1滴与水20ml,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应 | 【用法用量】成人:口服,一次0.6~0.9g(一次2~3片),一日3次,餐前1小时服用 |
| 【详细用法】详见说明书 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com