
科目: 来源: 题型:选择题
| A. | 碘单质-分子晶体 | B. | 铝铜铁合金-准晶体 | ||
| C. | 石墨-原子晶体 | D. | 氧化镁-离子晶体 |
查看答案和解析>>
科目: 来源: 题型:实验题
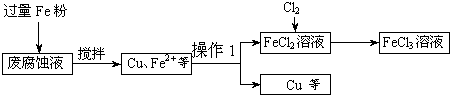

查看答案和解析>>
科目: 来源: 题型:实验题
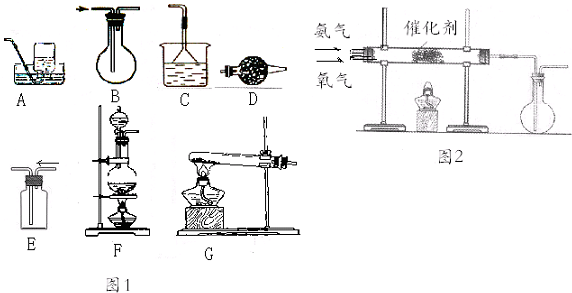
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 氯化镁溶液与氨水反应:Mg2++2OH-→Mg(OH)2↓ | |
| B. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32--+H2O?HCO3-+OH- | |
| C. | 向Ca(HCO3)2溶液中滴加过量的NaOH溶液:Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O | |
| D. | 向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+→Fe3++3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 | |
| B. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] | |
| C. | pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 | |
| D. | 0.10 mol•L-1 Na2CO3溶液:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室做钠的实验时,余下的钠屑投入到废液缸中 | |
| B. | 实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| C. | 把玻璃管插入橡胶塞孔时,可用厚布护手,紧握用水湿润的玻管,缓慢旋进塞孔中 | |
| D. | 实验室制乙酸丁酯时,须用水浴加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com