
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH3CH2Br+NaOH$\stackrel{H_{2}O}{→}$CH3CH2OH+NaBr | |
| D. | 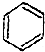 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$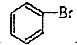 +HBr +HBr |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X3Y | B. | X3Y2 | C. | X2Y3 | D. | XY3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | V=1.12 | B. | 原混合酸中c(H2SO4)=0.1mol•L-1 | ||
| C. | 原混合酸中c(H+)=2mol•L-1 | D. | 另一份中消耗铁5.6g |
查看答案和解析>>
科目: 来源: 题型:解答题
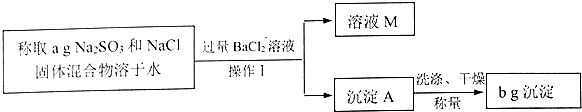
查看答案和解析>>
科目: 来源: 题型:选择题
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| A. | K+一定存在,且c(K+)≤1.3mol•L-1 | |
| B. | 实验I能确定一定不存在的离子是Ag+、Mg2+、Ba2+ | |
| C. | 实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓ | |
| D. | 实验III能确定一定不存在SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的还原性:HI>H2SO3>HCl | |
| B. | HI与H2SO3的物质的量浓度为0.6 mol•L-1 | |
| C. | 通入0.1molCl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O=4SO42-+I2+10Cl-+16H+ | |
| D. | 若再通入0.05molCl2,恰好能将HI和H2SO3完全氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com