
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
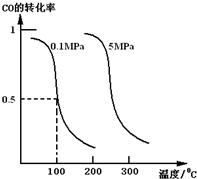 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)?CH3OH(g).
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)?CH3OH(g).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将2molSO3气体通入一密闭容器中,反应达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol | |
| B. | 向20mL0.5mol•L-1FeBr2溶液中通入224mL Cl2(标准状况):2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液 Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀::2Ba2++Al3++2SO42-+4OH-═2H2O+2BaSO4↓+AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com