
科目: 来源: 题型:填空题
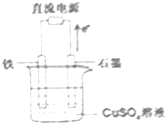 在如图所示装置中,石墨电极的电极反应式为4OH--4e-=2H2O+O2↑.如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是CuO(填化学式),其质量为40g.
在如图所示装置中,石墨电极的电极反应式为4OH--4e-=2H2O+O2↑.如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是CuO(填化学式),其质量为40g.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
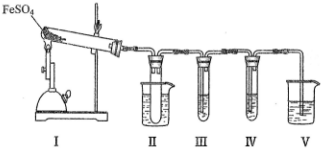
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入BaCl2溶液 | 产生白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入酸性 KMnO4 溶液 | 若溶液紫色褪去, 证明气体产物中含有SO2, 若溶液紫色无明显变化, 证明气体产物中不含SO2 |
查看答案和解析>>
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
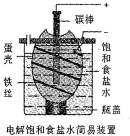 某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )
某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )| A. | 通电一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色 | |
| B. | 蛋壳表面缠绕的铁丝发生氧化反应 | |
| C. | 碳棒上产生的气体能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 电解一段时间后,蛋壳外溶液的pH下降 |
查看答案和解析>>
科目: 来源: 题型:实验题

 ,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.
,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.| 甲同学选择的试剂 | 乙同学认为不合理的理由 |
| 紫色石蕊试液 | |
| 新制氢氧化铜 |
查看答案和解析>>
科目: 来源: 题型:解答题
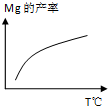 除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)查看答案和解析>>
科目: 来源: 题型:多选题
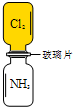 室温下,抽取图两瓶体积相等的氯气和氨气之间的玻璃片后,立即观察到有浓郁白烟,同时一瓶中黄绿色迅速褪去.充分反应后体系中的还原产物是( )
室温下,抽取图两瓶体积相等的氯气和氨气之间的玻璃片后,立即观察到有浓郁白烟,同时一瓶中黄绿色迅速褪去.充分反应后体系中的还原产物是( )| A. | NH4Cl | B. | HCl | C. | N2 | D. | H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原电池的电极一定要由两种不同的金属组成 | |
| B. | 原电池的负极得电子,发生还原反应 | |
| C. | 原电池工作时,其正极不断产生电子并经外电路流向负极 | |
| D. | 原电池能将化学能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com