
科目: 来源: 题型:解答题
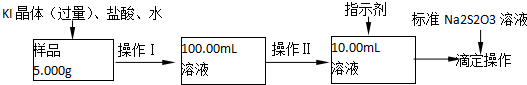
查看答案和解析>>
科目: 来源: 题型:解答题
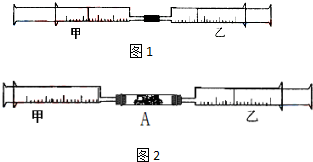 如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).
如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40mL HCl | 40mL NH3 | 产生白烟 |
| 2 | 40mL Cl2 | 10mL 水 | 剩余气体为20mL |
| 3 | 30mL NO | 15mL O2 | |
| 4 | 20mL AlCl3溶液 | 10mL NaOH溶液 | 生成白色沉淀,后消失 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 检验乙炔中是否混有H2S:湿润的醋酸铅试纸 | |
| B. | 盐酸滴定NaHCO3溶液:酚酞 | |
| C. | 检验淀粉是否完全水解:碘水 | |
| D. | 检验氯化氢是否集满:湿润的pH试纸 |
查看答案和解析>>
科目: 来源: 题型:解答题
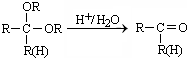
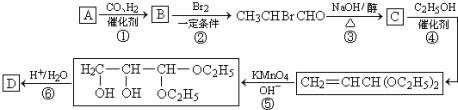
 CH2=CHCHO+NaBr+H2O.
CH2=CHCHO+NaBr+H2O.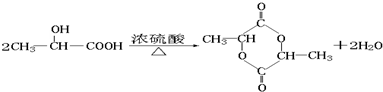 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4,mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3,mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目: 来源: 题型:解答题
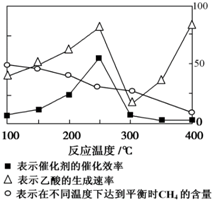 甲烷既是一种清洁能源,也是一种重要的化工原料.用催化剂可以将CO2和CH4直接转化成乙酸,反应方程式为:CO2(g)+CH4(g)?CH3COOH(g).
甲烷既是一种清洁能源,也是一种重要的化工原料.用催化剂可以将CO2和CH4直接转化成乙酸,反应方程式为:CO2(g)+CH4(g)?CH3COOH(g).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ②③ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com