
科目: 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ④>①>②>③ | C. | ②>①=③>④ | D. | ①>②=③>④ |
查看答案和解析>>
科目: 来源: 题型:选择题
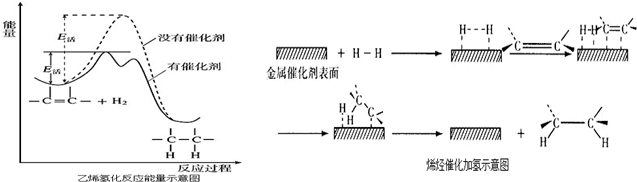
| A. | 乙烯和H2生成乙烷的反应是吸热反应 | |
| B. | 加入催化剂,可减小反应的热效应 | |
| C. | 催化剂能改变平衡转化率,不能改变化学反应的平衡常数 | |
| D. | 催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体 |
查看答案和解析>>
科目: 来源: 题型:解答题
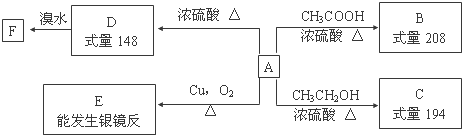
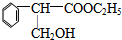 ,F的结构简式为
,F的结构简式为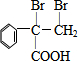 .
.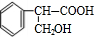 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$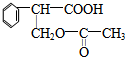 +H2O;②A→E:2
+H2O;②A→E:2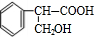 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.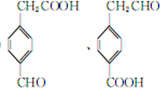 .
.查看答案和解析>>
科目: 来源: 题型:实验题

| 反应前质量/g | 反应后质量/g | |
| U型管+固体 | a | b |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c( S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 溶液I中含有溶质的组合可能有4种 | |
| B. | 已知V和a的具体数值可以确定溶液I的溶质 | |
| C. | 已知溶液I中溶质的种类和a值,一定能求出V | |
| D. | 向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克.由W和V的值可确定溶液I的溶质 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲苯的分子式为: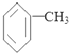 | |
| B. | 甲苯分子中所有原子都处于同一平面 | |
| C. | 甲苯的一氯取代物有5种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 甲苯和苯互为同系物 |
查看答案和解析>>
科目: 来源: 题型:实验题
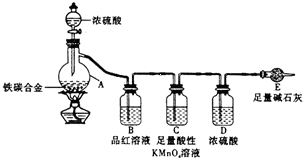 某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com